在制药行业中,除需要安全可靠的密封解决方案外,还需要避免污染物及细菌的产生,否则后果非常严重。实践证明,在生产时,如果更换物料通过拆卸设备进行清洁是极其复杂、成本高且耗时的,因此闭环系统中的清洁工艺在医药行业得到广泛推广和应用。
CIP(Clean In Place,在线清洗)和 SIP (Sterilize In Place,在线灭菌)清洁工艺可以追溯到 1950 年代,最初用于食品和乳制品行业。制药行业中的CIP在线清洗和SIP在线灭菌实施过程中,密封件的可清洁性是避免故障发生时的一个重要考量因素。
Garlock根据欧洲卫生工程和设计组织(简称EHEDG)指南第2号文件的可清洁性测试程序,用 GYLON BIO-PRO® PLUS 系列管道用卡箍垫片和多种卡箍用密封件材料进行测试,对比密封件的可清洁性,并检查CIP清洁程序后密封件的残留微生物状态,来验证什么是真正的医药用洁净密封方案。试验中通过生长培养基中pH纸从紫色到黄色的颜色变化来检测判断微生物的存在,因为一旦存在形成酸的微生物,pH 指示剂溴甲酚紫色就会改变颜色。

▲在德国某化学和生物技术实验室进行的CIP在线清洗测试台
可清洁性测试程序符合EHEDG 指南第2号文件中要求(CIP 测试评估程序,2007 版本),步骤如下:
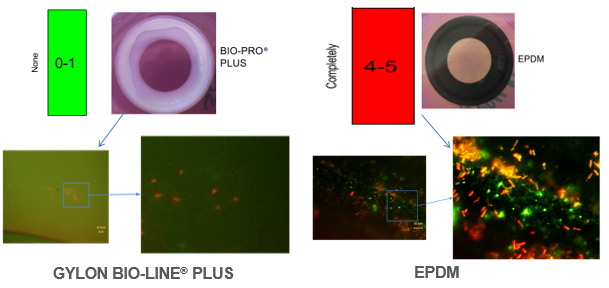
随后拆下清洗后的卡箍垫片,并对卡箍垫片进行表面残留物(污染)的检查,将清洗过的密封圈放置在培养皿中,在密封件表面涂覆上EHEDG指定配方和处理后的培养基。然后将涂覆好的待测垫圈在 58°C 下培育 24 小时。测试菌株的孢子在培养基中生长,如果清洗过程不成功,培养基在培养过程中会先变绿,然后变黄,表明存在的活性孢子产生了明确的颜色反应。黄色越明显,清洁后垫圈表面上残留的污染物越多。如下图所示,绿色表示无污染,黄色位中度污染,红色为重度污染。

▲不同的卡箍密封件清洁测试后的外观
使用荧光显微镜和着色方法比较垫片上的残留物,活的有机物以绿色出现,死的有机物显示为红色。
▲荧光显微镜下卡箍密封件表面的微生物
从测试中不难看出,GYLON BIO-PRO® PLUS 3522 材料对比其它密封材料显示出非常好的密封洁净效果,以EPDM橡胶弹性体为例,EPDM垫圈在测试期间出现任何明显变黄,追加使用荧光显微镜进行的进一步检查表明,EPDM垫圈其实已被重度污染。相比之下,GYLON BIO-PRO® PLUS 3522 在测试中没有变黄,采用荧光显微镜观察也只有微量污染物。试验证明 GYLON BIO-PRO® PLUS 3522 材料在在线清洁过程中显示出非常优秀的洁净效果荧光显微镜图像。EHEDG第2号文件要求本清洁性测试需要先判定材料的成分中不含抗菌特性的成分,否则将导致测试失败。

GYLON BIO-PRO® PLUS 3522 卓越的可清洁性可帮助制药企业提高产品安全性,可通过增加产品产量优化药厂工艺效率。
GYLON BIO-PRO® PLUS适合医药行业CIP/SIP工况,具备的特点:
想了解更多详情,请访问:www.garlock.com.cn
客服热线:400 894 1288
邮箱:sales.china@garlock.com